上海金畔生物科技有限公司代理AAT Bioquest荧光染料全线产品,欢迎访问AAT Bioquest荧光染料官网了解更多信息。
trFluor Tb马来酰亚胺(停产)
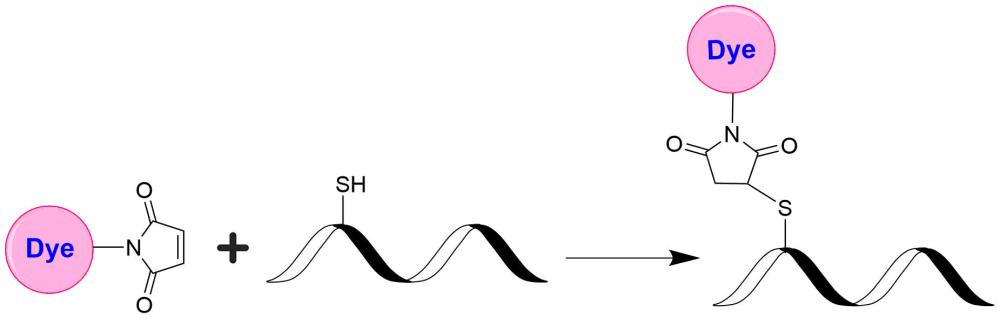 |
货号 | 1444 | 存储条件 | 在零下15度以下保存, 避免光照 |
| 规格 | 100 ug | 价格 | 0 | |
| Ex (nm) | 333 | Em (nm) | 544 | |
| 分子量 | 1123.92 | 溶剂 | DMSO | |
| 产品详细介绍 | ||||
简要概述
trFluor Tb马来酰亚胺是美国AAT Bioquest生产的荧光染料,存在于细胞,血清或其他生物流体中的许多生物化合物是天然荧光的,因此使用常规的快速荧光团导致测定灵敏度的严重限制,这是由于待测定的生物分子的自发荧光引起的高背景。使用长寿命荧光团结合时间分辨检测(激发和发射检测之间的延迟)可以最大限度地减少瞬间荧光干扰。我们的trFluor Eu探针可为需要高灵敏度的分析启用时间分辨荧光检测(TRF)。与更传统的荧光团如Alexa Fluor或花青染料相比,这些trFluor Eu探针具有较大的斯托克斯位移和极长的发射半衰期。与其他TRF化合物相比,我们的trFluor Eu探针具有相对较高的稳定性,高排放产量和与生物分子相关的能力。此外,我们的trFluor Eu探针在与抗体等生物聚合物结合时对荧光猝灭不敏感。金畔生物是AAT Bioquest的中国代理商,为您提供最优质的trFluor Tb马来酰亚胺。
点击查看光谱
点击查看实验方案
产品说明书
样本标记步骤
注意:该标记方案是针对山羊抗小鼠IgG与trFluor Eu SE的缀合物开发的。请根据您的具体实验进行调整。
1.准备蛋白质储备溶液(溶液A):
将100L反应缓冲液(例如,1M碳酸钠溶液或1M磷酸盐缓冲液,pH~9.0)与900L目标蛋白质溶液(例如抗体,蛋白质浓度> 2mg / ml,如果可能)混合,得到1 mL蛋白标记储备液。
注意1:蛋白质溶液(溶液A)的pH值应为8.5±0.5。 如果蛋白质溶液的pH低于8.0,则使用1M碳酸氢钠溶液或1M pH 9.0磷酸盐缓冲液将pH调节至8.0-9.0的范围。
注意2:蛋白质应溶解于pH7.2-7.4的1X磷酸盐缓冲盐水(PBS)中。 如果蛋白质溶解在Tris或甘氨酸缓冲液中,则必须用pH7.2-7.4的1X PBS透析,以除去广泛用于蛋白质沉淀的游离胺或铵盐(例如硫酸铵和乙酸铵)。
注意3:用牛血清白蛋白(BSA)或明胶稳定的不纯抗体或抗体不能很好地标记。 叠氮化钠或硫柳汞的存在也可能干扰缀合反应。 可以通过透析或旋转柱除去叠氮化钠或硫柳汞,以获得最佳标记结果。
注意4:如果蛋白质浓度低于2 mg / mL,则结合效率显着降低。 为获得最佳标记效率,建议最终蛋白质浓度范围为2-10 mg / mL。
2.准备染料储备溶液(溶液B):
将无水DMSO加入到小瓶trFluor?Eu SE中以制备10-20mM储备溶液。 通过移液或涡旋混合均匀。
注意:在开始缀合之前准备染料储备溶液(溶液B),需及时使用。染料储备溶液的长期储存可降低染料活性。溶液B可以在不受光照和潮湿的情况下储存在冰箱中两周。避免冻融循环。
3.确定最佳染料/蛋白质比例(可选):
注意:每种蛋白质都需要不同的染料/蛋白质比例,这也取决于染料的性质。 蛋白质的过度标记可能对其结合亲和力产生不利影响,而低染料/蛋白质比率的蛋白质结合物会降低灵敏度。 我们建议您通过使用连续不同量的标记染料溶液重复步骤4和5来实验确定最佳染料/蛋白质比率。 通常,对于大多数染料 – 蛋白质缀合物,推荐使用4-6种染料/蛋白质。
3.1使用10:1摩尔比的溶液B(染料)/溶液A(蛋白质)作为起点:将5μl染料储备溶液(溶液B,假设染料储备溶液为10 mM)加入到样品瓶中。 蛋白质溶液(95μl溶液A)有效摇动。 假设蛋白质浓度为10mg / mL并且蛋白质的分子量为~200KD,蛋白质的浓度为~0.05mM。
注意:蛋白质溶液中DMSO的浓度应<10%。
3.2运行结合反应(见下面的步骤4)。
3.3重复#3.2,溶液B /溶液A的摩尔比为5:1; 分别为15:1和20:1。
3.4使用预制的旋转柱纯化所需的缀合物。
3.5计算上述4种结合物的染料/蛋白质比例(DOS)(见下文)。
3.6运行上述4种结合物的功能测试,确定最佳的染料/蛋白质比例,以扩大标记反应。
4.运行结合反应:
4.1在有效摇动下,将适量的染料储备溶液(溶液B)加入到蛋白质溶液(溶液A)的小瓶中。
注意:溶液B /溶液的最佳摩尔比由步骤3.6确定。 如果跳过步骤3,我们建议使用10:1摩尔比的溶液B(染料)/溶液A(蛋白质)。
4.2继续在室温下旋转或摇动反应混合物30-60分钟。
5.纯化缀合物
以下方案是使用Sephadex G-25柱纯化染料 – 蛋白质缀合物的实例。
5.1按照制造说明准备Sephadex G-25色谱柱。
5.2将反应混合物(直接来自步骤4)加载到Sephadex G-25柱的顶部。
5.3一旦样品在顶部树脂表面下方运行,加入PBS(pH 7.2-7.4)。
5.4将更多PBS(pH 7.2-7.4)加入所需样品中以完成柱纯化。 合并含有所需染料 – 蛋白质缀合物的级分。
注意1:立即使用时,染料 – 蛋白质偶联物需要用染色缓冲液稀释,并等分多次使用。
注意2:对于长期储存,染料 – 蛋白质缀合物溶液需要浓缩或冷冻干燥(见说明书)。
参考文献
Development of a time-resolved fluorescence resonance energy transfer assay for cyclin-dependent kinase 4 and identification of its ATP-noncompetitive inhibitors
Authors: Lo MC, Ngo R, Dai K, Li C, Liang L, Lee J, Emkey R, Eksterowicz J, Ventura M, Young SW, Xiao SH.
Journal: Anal Biochem (2012): 368
Time-Resolved Fluorescence Resonance Energy Transfer as a Versatile Tool in the Development of Homogeneous Cellular Kinase Assays
Authors: Saville L, Spais C, Mason JL, Albom MS, Murthy S, Meyer SL, Ator MA, Angeles TS, Husten J.
Journal: Assay Drug Dev Technol. (2012)
A homogeneous single-label time-resolved fluorescence cAMP assay
Authors: Martikkala E, Rozwandowicz-Jansen A, Hanninen P, Petaja-Repo U, Harma H.
Journal: J Biomol Screen (2011): 356
Homogeneous time-resolved fluorescence-based assay to screen for ligands targeting the growth hormone secretagogue receptor type 1a
Authors: Leyris JP, Roux T, Trinquet E, Verdie P, Fehrentz JA, Oueslati N, Douzon S, Bourrier E, Lamarque L, Gagne D, Galleyrand JC, M’Kadmi C, Martinez J, Mary S, Baneres JL, Marie J.
Journal: Anal Biochem (2011): 253
Oligomerization of the serotonin(1A) receptor in live cells: a time-resolved fluorescence anisotropy approach
Authors: Paila YD, Kombrabail M, Krishnamoorthy G, Chattopadhyay A.
Journal: J Phys Chem B (2011): 11439
Time-resolved fluorescence resonance energy transfer (TR-FRET) to analyze the disruption of EGFR/HER2 dimers: a new method to evaluate the efficiency of targeted therapy using monoclonal antibodies
Authors: Gaborit N, Larbouret C, Vallaghe J, Peyrusson F, Bascoul-Mollevi C, Crapez E, Azria D, Chardes T, Poul MA, Mathis G, Bazin H, Pelegrin A.
Journal: J Biol Chem (2011): 11337
A time-resolved fluorescence-resonance energy transfer assay for identifying inhibitors of hepatitis C virus core dimerization
Authors: Kota S, Scampavia L, Spicer T, Beeler AB, Takahashi V, Snyder JK, Porco JA, Hodder P, Strosberg AD.
Journal: Assay Drug Dev Technol (2010): 96
Ligand regulation of the quaternary organization of cell surface M3 muscarinic acetylcholine receptors analyzed by fluorescence resonance energy transfer (FRET) imaging and homogeneous time-resolved FRET
Authors: Alvarez-Curto E, Ward RJ, Pediani JD, Milligan G.
Journal: J Biol Chem (2010): 23318
Steady-state and time-resolved fluorescence quenching with transition metal ions as short-distance probes for protein conformation
Authors: Posokhov YO, Kyrychenko A, Ladokhin AS.
Journal: Anal Biochem (2010): 284
Time-resolved FRET fluorescence spectroscopy of visible fluorescent protein pairs
Authors: Visser AJ, Laptenok SP, Visser NV, van Hoek A, Birch DJ, Brochon JC, Borst JW.
Journal: Eur Biophys J (2010): 241
