钙离子荧光探针Fluo-8FF,钾盐
 |
货号 |
21103 |
存储条件 |
在零下15度以下保存, 避免光照 |
| 规格 |
1 mg |
价格 |
3924 |
| Ex (nm) |
495 |
Em (nm) |
516 |
| 分子量 |
913.05 |
溶剂 |
Water |
| 产品详细介绍 |
简要概述
钙离子荧光探针Fluo-8FF,钾盐是美国AAT Bioquest生产的用于钙通量测定的试剂,钙测量对于许多生物学研究至关重要。在结合Ca2+后显示光谱响应的荧光探针使研究人员能够使用荧光显微镜,流式细胞仪,荧光光谱和荧光酶标仪来研究细胞内游离Ca2+浓度的变化。在可见光激发钙指示剂中,Fluo-3和Fluo-4最常用。但是,Fluo-3 AM和Fluo-4 AM在酯酶水解后在活细胞中仅适度发荧光,并且需要苛刻的细胞加载条件才能最大化其细胞钙反应。开发Fluo-8®染料可改善细胞负载和钙响应,同时保持便捷的Fluo-3和Fluo-4光谱波长(在〜490 nm处具有最大激发和在〜520 nm处具有最大发射)。Fluo-8®AM仅需要室温,而Fluo-3 AM和Fluo-4 AM需要37℃的细胞负载。此外,Fluo-8®的亮度是Fluo-4 AM的2倍,是Fluo-3 AM的4倍。AAT Bioquest提供了一套出色的Fluo-8®试剂,具有不同的钙结合亲和力(Fluo-8®:Kd = 389 nM; Fluo-8H:Kd = 232 nM; Fluo-8L:Kd = 1.86 µM; Fluo-8FF :Kd = 10 µM)。金畔生物是AAT Bioquest 的中国代理商,为您提供最优质的钙离子荧光探针Fluo-8FF,钾盐。
点击查看光谱
钙离子篇:时间轴式讲解应用于钙离子检测的探针
产品说明书
操作步骤
1.使用钙指示剂AM Esters加载细胞:
AM酯是非极性酯,其易于穿过活细胞膜,并且通过活细胞内的细胞酯酶快速水解。 AM酯广泛用于非侵入性地将各种极性荧光探针装载到活细胞中。 但是,使用AM酯时必须小心,因为它们易于水解,特别是在溶液中。 它们应在使用前用高质量的无水二甲基亚砜(DMSO)重新配制。 DMSO储备溶液应在-20°C下干燥储存并避光。 在这些条件下,AM酯应稳定数月。
以下是我们推荐的将AM酯加载到活细胞中的方案。该方案仅提供指南,实际情况应根据您的具体需求进行修改。
a)在高质量无水DMSO中制备2至5 mM AM酯原液。
b)在实验当天,将钙指示剂溶解在DMSO中或将等份的指示剂储备溶液解冻至室温。使用0.02%Pluronic®F-127在您选择的缓冲液(如Hanks和Hepes缓冲液)中制备1至10μM的工作溶液。对于大多数细胞系,我们建议钙指示剂的最终浓度为4-5 uM。 细胞加载所需指标的确切浓度必须根据经验确定。 为避免因过载和潜在染料毒性引起的任何伪影,建议使用可产生足够信号强度的最小探针浓度。
注意:非离子洗涤剂Pluronic®F-127有时用于增加钙指示剂AM酯的水溶性。
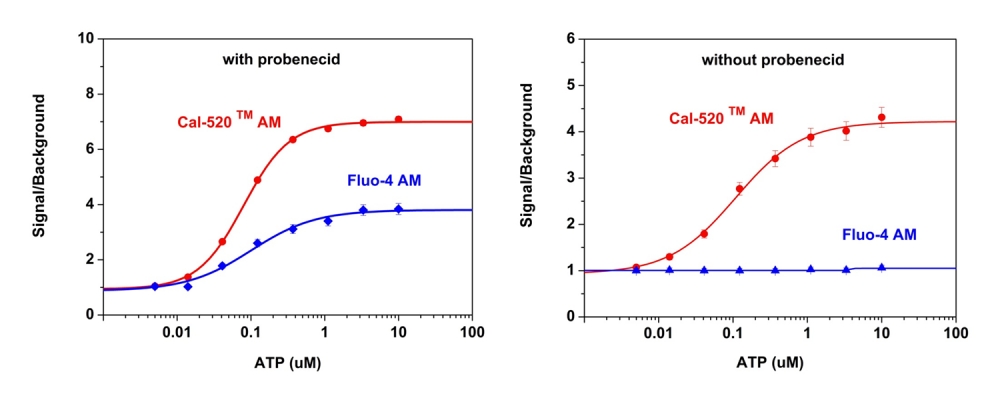
c)如果您的细胞含有有机阴离子转运蛋白,可以在细胞培养基中加入丙磺舒(1-2.5 mM)或磺吡酮(0.1-0.25 mM),以减少脱酯化指标的泄漏。 在室温或37°C下用钙指示剂酯孵育细胞20分钟至1小时。
d)在HHBS或您选择的缓冲液(含有阴离子转运蛋白抑制剂,如2.5mM丙磺舒,如果适用)中洗涤细胞1-2次以除去过量的探针。
e)在所需的Ex / Em波长下进行实验(见说明书中的表1)。
2.测量细胞内钙响应:
为了确定溶液的游离钙浓度或单波长钙指示剂的Kd,使用以下等式:[Ca]free = Kd[F – Fmin]/Fmax – F]
其中F是实验钙水平下指示剂的荧光,Fmin是不存在钙时的荧光,Fmax是钙饱和探针的荧光。 解离常数(Kd)是探针对钙的亲和力的量度。 与校准溶液相比,荧光指示剂的Ca2 +结合和光谱性质在细胞环境中变化非常显着。 细胞内指标的原位校准通常产生显着高于体外测定的Kd值。 通过在离子载体如A-23187,4-溴A-23187和离子霉素存在下将加载的细胞暴露于受控的Ca 2+缓冲液来进行原位校准。 或者,细胞透化剂如洋地黄皂苷或X-100可用于将指示剂暴露于细胞外培养基的受控Ca2 +水平。 说明书中的表1列出了一些钙试剂的Kd值供您参考。
试剂应用文献
AMPA receptors in the synapse turnover by monomer diffusion
Authors: Morise, Jyoji and Suzuki, Kenichi GN and Kitagawa, Ayaka and Wakazono, Yoshihiko and Takamiya, Kogo and Tsunoyama, Taka A and Nemoto, Yuri L and Takematsu, Hiromu and Kusumi, Akihiro and Oka, Shogo
Journal: Nature communications (2019): 1–18
Cryo-EM Studies of TMEM16F Calcium-Activated Ion Channel Suggest Features Important for Lipid Scrambling
Authors: Feng, Shengjie and Dang, Shangyu and Han, Tina Wei and Ye, Wenlei and Jin, Peng and Cheng, Tong and Li, Junrui and Jan, Yuh Nung and Jan, Lily Yeh and Cheng, Yifan
Journal: Cell Reports (2019): 567–579
Discrimination of Dormant and Active Hematopoietic Stem Cells by G0 Marker Reveals Dormancy Regulation by Cytoplasmic Calcium
Authors: Fukushima, Tsuyoshi and Tanaka, Yosuke and Hamey, Fiona K and Chang, Chih-Hsiang and Oki, Toshihiko and Asada, Shuhei and Hayashi, Yasutaka and Fujino, Takeshi and Yonezawa, Taishi and Takeda, Reina and others
Journal: Cell Reports (2019): 4144–4158
Ketamine Increases Proliferation of Human iPSC-Derived Neuronal Progenitor Cells via Insulin-Like Growth Factor 2 and Independent of the NMDA Receptor
Authors: Grossert, Aless and ra and Mehrjardi, Narges Zare and Bailey, Sarah J and Lindsay, Mark A and Hescheler, Jürgen and Saric, Tomo and Teusch, Nicole
Journal: Cells (2019): 1139
MRGPRX4 is a bile acid receptor for human cholestatic itch
Authors: Yu, Huasheng and Zhao, Tianjun and Liu, Simin and Wu, Qinxue and Johnson, Omar and Wu, Zhaofa and Zhuang, Zihao and Shi, Yaocheng and Peng, Luxin and He, Renxi and others
Journal: eLife (2019): e48431
P2Y6 signaling in alveolar macrophages prevents leukotriene-dependent type 2 allergic lung inflammation
Authors: Nagai, Jun and Balestrieri, Barbara and Fanning, Laura B and Kyin, Timothy and Cirka, Haley and Lin, Junrui and Idzko, Marco and Zech, Andreas and Kim, Edy Y and Brennan, Patrick J and others
Journal: The Journal of clinical investigation (2019)
Hyperglycaemia disrupts conducted vasodilation in the resistance vasculature of db/db mice
Authors: Lemmey, Hamish AL and Ye, Xi and Ding, Hong C and Triggle, Christopher R and Garland, Christopher J and Dora, Kim A
Journal: Vascular pharmacology (2018): 29–35
Methionine and valine activate the mammalian target of rapamycin complex 1 pathway through heterodimeric amino acid taste receptor (TAS1R1/TAS1R3) and intracellular Ca2+ in bovine mammary epithelial cells
Authors: Zhou, Y and Zhou, Z and Peng, J and Loor, Juan J
Journal: Journal of dairy science (2018): 11354–11363
TRPA1-dependent reversible opening of tight junction by natural compounds with an $alpha$, $beta$-unsaturated moiety and capsaicin
Authors: Kanda, Yusuke and Yamasaki, Youhei and Sasaki-Yamaguchi, Yoshie and Ida-Koga, Noriko and Kamisuki, Shinji and Sugawara, Fumio and Nagumo, Yoko and Usui, Takeo
Journal: Scientific reports (2018): 1–13
A new electro-optical approach for conductance measurement: an assay for the study of drugs acting on ligand-gated ion channels
Authors: Menegon, A and Pitassi, S and Mazzocchi, N and Redaelli, L and Rizzetto, R and Roll and JF and Poli, C and Imberti, M and Lanati, A and Grohovaz, F
Journal: Scientific Reports (2017)
Altered spontaneous calcium signaling of in situ chondrocytes in human osteoarthritic cartilage
Authors: Gong, Xiaoyuan and Xie, Wenbin and Wang, Bin and Gu, Lingchuan and Wang, Fuyou and Ren, Xiang and Chen, Cheng and Yang, Liu
Journal: Scientific reports (2017): 17093
Bystander effects elicited by single-cell photo-oxidative blue-light stimulation in retinal pigment epithelium cell networks
Authors: Ishii, Masaaki and Rohrer, Bärbel
Journal: Cell Death Discovery (2017): 16071
Bystander effects elicited by single-cell photo-oxidative blue-light stimulation in retinal pigment epithelium cell networks
Authors: Ishii, Masaaki and Rohrer, Bärbel
Journal: Cell Death Discovery (2017): 16071
High-throughput screen detects calcium signaling dysfunction in typical sporadic autism spectrum disorder
Authors: Schmunk, Galina and Nguyen, Rachel L and Ferguson, David L and Kumar, Kenny and Parker, Ian and Gargus, J Jay
Journal: Scientific Reports (2017): 40740
参考文献
2-OMe-lysophosphatidylcholine analogues are GPR119 ligands and activate insulin secretion from βTC-3 pancreatic cells: Evaluation of structure-dependent biological activity
Authors: Anna Drzazga, Agata Sowińska, Agnieszka Krzemińska, Andrzej Okruszek, Piotr Paneth, Maria Koziolkiewicz, Edyta Gendaszewska-Darmach
Journal: Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids (2017)
A new electro-optical approach for conductance measurement: an assay for the study of drugs acting on ligand-gated ion channels
Authors: A Menegon, S Pitassi, N Mazzocchi, L Redaelli, R Rizzetto, JF Rolland, C Poli, M Imberti, A Lanati, F Grohovaz
Journal: Scientific Reports (2017)
Altered spontaneous calcium signaling of in situ chondrocytes in human osteoarthritic cartilage
Authors: Xiaoyuan Gong, Wenbin Xie, Bin Wang, Lingchuan Gu, Fuyou Wang, Xiang Ren, Cheng Chen, Liu Yang
Journal: Scientific reports (2017): 17093
Analysis of Ca2+ response of osteocyte network by three-dimensional time-lapse imaging in living bone
Authors: Tomoyo Tanaka, Mitsuhiro Hoshijima, Junko Sunaga, Takashi Nishida, Mana Hashimoto, Naoya Odagaki, Ryuta Osumi, Taiji Aadachi, Hiroshi Kamioka
Journal: Journal of Bone and Mineral Metabolism (2017): 1–10
Aryl-and alkyl-phosphorus-containing flame retardants induced mitochondrial impairment and cell death in Chinese hamster ovary (CHO-k1) cells
Authors: Chao Huang, Na Li, Shengwu Yuan, Xiaoya Ji, Mei Ma, Kaifeng Rao, Zijian Wang
Journal: Environmental Pollution (2017): 775–786
Bystander effects elicited by single-cell photo-oxidative blue-light stimulation in retinal pigment epithelium cell networks
Authors: Masaaki Ishii, Bärbel Rohrer
Journal: Cell Death Discovery (2017): 16071
Ca 2+ signals initiate at immobile IP 3 receptors adjacent to ER-plasma membrane junctions
Authors: Nagendra Babu Thillaiappan, Alap P Chavda, Stephen C Tovey, David L Prole, Colin W Taylor
Journal: Nature Communications (2017): 1505
Cells smell on a CMOS: A portable odorant detection system using cell-laden collagen pillars
Authors: Yusuke Hirata, Yuya Morimoto, Eunryel Nam, Shotaro Yoshida, Shoji Takeuchi
Journal: (2017): 13–16
Ex vivo replication of phenotypic functions of osteocytes through biomimetic 3D bone tissue construction
Authors: Qiaoling Sun, Saba Choudhary, Ciaran Mannion, Yair Kissin, Jenny Zilberberg, Woo Y Lee
Journal: Bone (2017)
High Glucose Enhances Isoflurane-Induced Neurotoxicity by Regulating TRPC-Dependent Calcium Influx
Authors: ZhongJie Liu, ChangQing Ma, Wei Zhao, QingGuo Zhang, Rui Xu, HongFei Zhang, HongYi Lei, ShiYuan Xu
Journal: Neurochemical Research (2017): 1–14
相关产品
| 产品名称 |
货号 |
| 钙离子荧光探针Cal-520 , AM |
Cat#21130 |
| 钙离子荧光探针Fluo-8, AM |
Cat#21080 |
| 新型钙离子荧光探针Calbryte 520, AM *细胞渗透性* |
Cat#20650 |
说明书
钙离子荧光探针Fluo-8FF,钾盐.pdf