上海金畔生物科技有限公司代理AAT Bioquest荧光染料全线产品,欢迎访问AAT Bioquest荧光染料官网了解更多信息。
钙离子荧光探针Rhod-4, AM
 |
货号 | 21123 | 存储条件 | 在零下15度以下保存, 避免光照 |
| 规格 | 20×50 ug | 价格 | 6564 | |
| Ex (nm) | 523 | Em (nm) | 551 | |
| 分子量 | 1015.96 | 溶剂 | DMSO | |
| 产品详细介绍 | ||||
简要概述
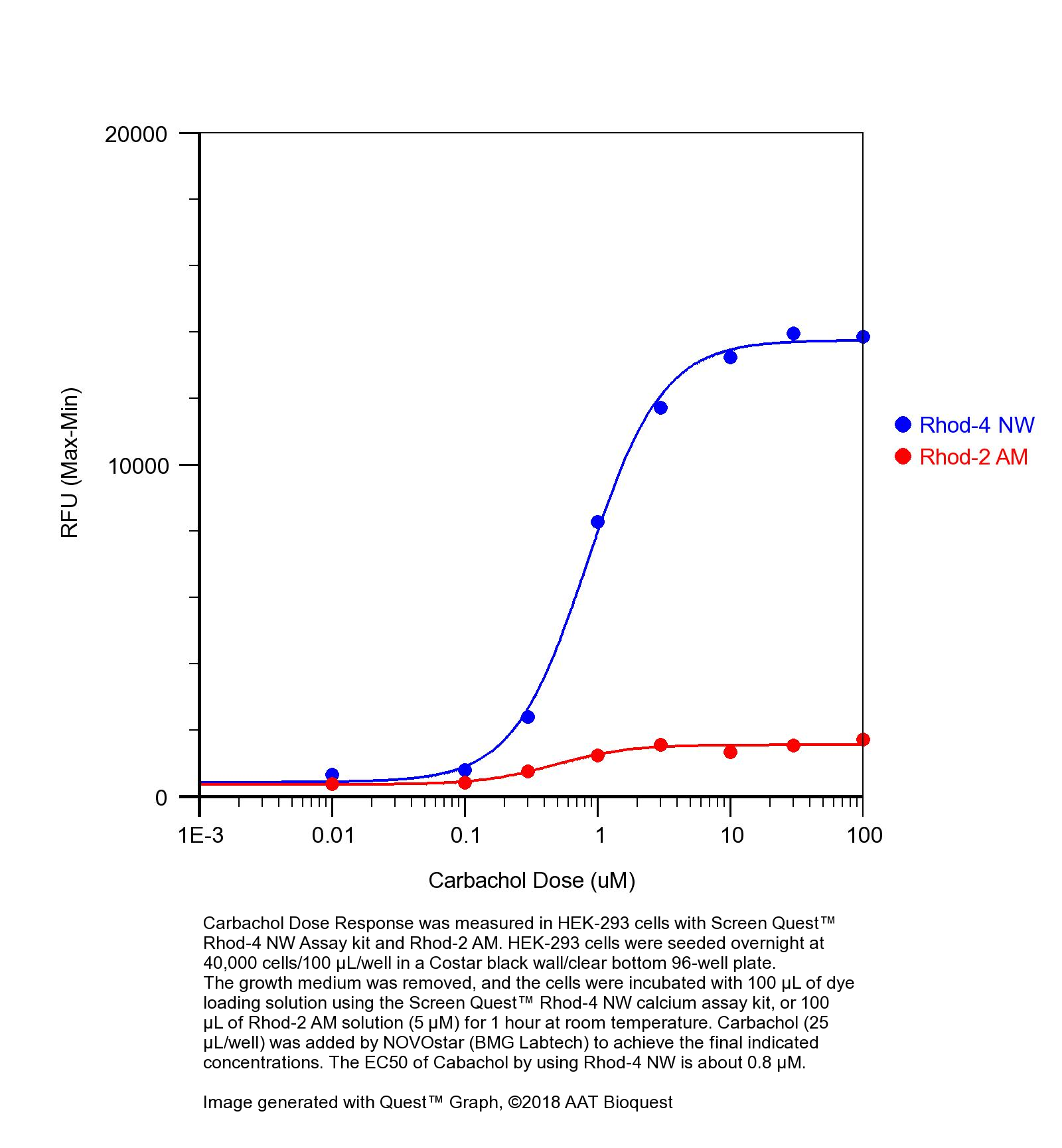
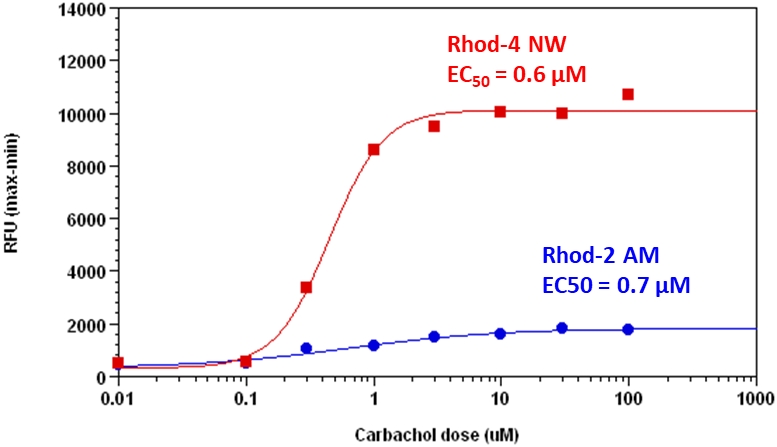
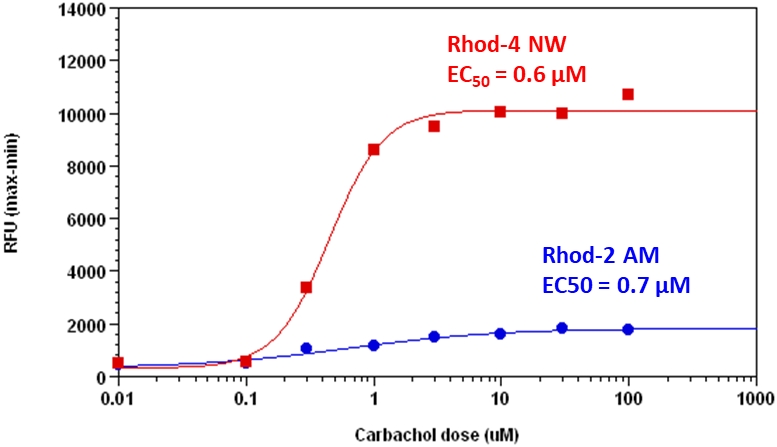
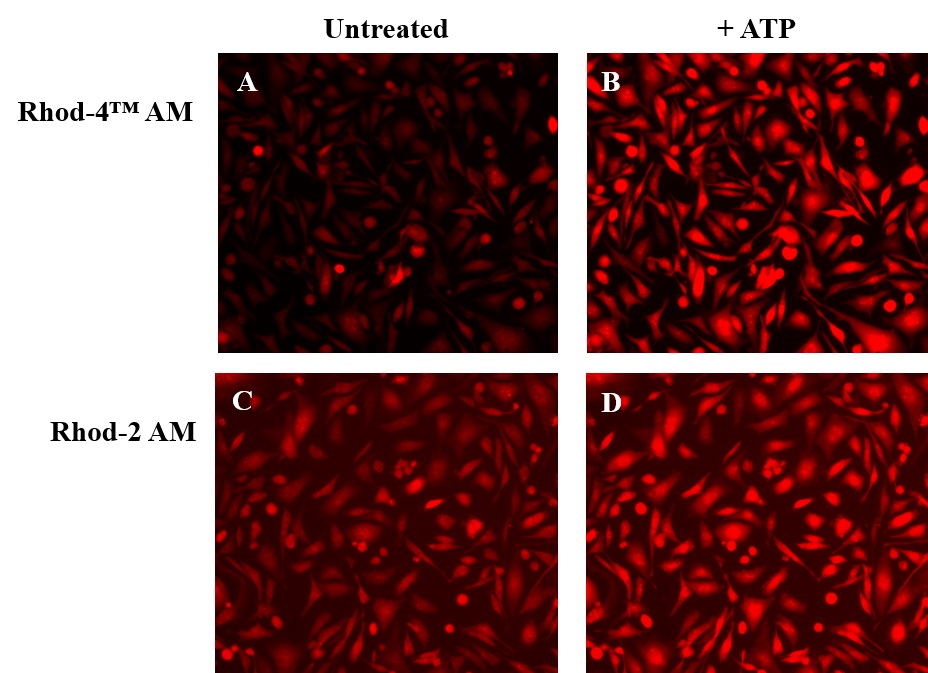
钙离子荧光探针Rhod-4, AM是美国AAT Bioquest生产的用于标记钙离子的荧光探针,钙的测量对于许多生物学研究至关重要。荧光探针显示结合Ca2+后的光谱响应,使研究人员能够通过荧光显微镜,流式细胞仪,荧光光谱和荧光酶标仪研究细胞内游离Ca2+浓度的变化。Rhod-2最常用于红色荧光钙指示剂中。然而,Rhod-2 AM在酯酶水解后仅在活细胞中发生中度荧光,并且具有非常小的细胞钙响应。Rhod-4 已被开发用于改善Rhod-2细胞负载和钙响应,同时保持Rhod-2的光谱波长。在CHO和HEK细胞中,Rhod-4 AM具有比Rhod-2 AM敏感10倍的细胞钙响应。AAT Bioquest提供多种包装尺寸的Quest Rhod-4,以满足您的特殊需求,例如1毫克; 10×50μg; 20×50μg; HTS包装,无需额外包装费用。金畔生物是AAT Bioquest 的中国代理商,为您提供最优质的钙离子荧光探针。
点击查看光谱
点击查看实验方案
钙离子篇:时间轴式讲解应用于钙离子检测的探针
适用仪器
| 荧光显微镜 | |
| 激发: | TRITC |
| 发射: | TRITC |
| 推荐孔板: | 黑色透明 |
| 荧光酶标仪 | |
| 激发: | 540nm |
| 发射: | 590nm |
| cutoff: | 570nm |
| 推荐孔板: | 黑色透明 |
| 读取模式: | 底读模式 |
产品说明书
操作步骤
1.准备HHBS缓冲液,10%Pluronic®F-127溶液和25 mM Probenecid溶液。
2.在高质量无水DMSO中制备2 mM至5 mM Rhod-4 ,AM原液。
2.1使用量的Rhod-4 ,AM:1 mg
2.2所需浓度:2 mM
2.3在合适的容器中,将1mg Rhod-4,AM与492.15μL无水DMSO混合。
3.使用10μMRhod-4 ,AM 4在HHBS中制备2X工作溶液,0.08%Pluronic®F-127和2 mM丙磺舒。
3.1最终井内浓度的Rhod-4 ,AM:5μM
3.2Pluronic®F-127的最终井内浓度:0.04%
3.3最终孔内浓度的丙磺舒:1mM
3.4在合适的容器中混合16μL的Rhod-4 ,AM,25.6μL的10%Pluronic F-127和256μL的25mM丙磺舒。然后,添加HHBS或您选择的缓冲液,直到体积为3.2 mL。
注意:对于大多数细胞系,我们建议使用Rhod-4 的最终浓度,AM为4至5μM。
注意:推荐的Pluronic F-127孔浓度最终为0.02%至0.04%。
注意:推荐的最终浓度为1至2.5 mM的Probenecid。
4.将100μL染料工作溶液加入已经含有100μL培养基的所需孔中。
4.1该步骤将染料工作溶液从2X稀释至1X,并将每种组分的最终浓度调节至以下:5μM的Rhod-4 ,AM,0.04%Pluronic F-127,1mM丙磺舒。
5.孵育染料
5.1将染料加载板在细胞培养箱中孵育20-120分钟。
5.2将染料加载板在室温下孵育30分钟。
6.用1.0 mM Probenecid准备HHBS缓冲液(或您选择的缓冲液)。
6.1在合适的容器中加入160μL的25mM丙磺舒。接下来,添加HHBS或您选择的缓冲液,直到体积为4 mL。
7.用HHBS缓冲液或您选择的缓冲液替换染料工作溶液,使用1.0 mM Probenecid。
7.1首先,从所需孔中除去200μL染料工作溶液和培养基。
7.2在相同的孔中加入200μL含有1.0mM丙磺舒的HHBS(或您选择的缓冲液)。
8.运行实验
8.1为您的样品添加所需的处理。
8.2以Ex / Em = 524/551 nm运行实验。
参考文献
Central role of IP 3 R2-mediated Ca 2+ oscillation in self-renewal of liver cancer stem cells elucidated by high-signal ER sensor
Authors: Cuiwei Sun, Bo Shui, Wei Zhao, Hui Liu, Wenwen Li, Jane C Lee, Robert Doran, Frank K Lee, Tao Sun, Qing Sunny Shen
Journal: Cell death & disease (2019): 396
Imaging elemental events of store-operated Ca2+ entry in invading cancer cells with plasmalemmal targeted sensors
Authors: Fujian Lu, Jianwei Sun, Qiaoxia Zheng, Jinghang Li, Yuanzhao Hu, Peng Yu, Huifang He, Yan Zhao, Xianhua Wang, Shengyu Yang
Journal: J Cell Sci (2019): jcs–224923
Autocrine GABA signaling distinctively regulates phenotypic activation of mouse pulmonary macrophages
Authors: Luan Januzi, Jacob W Poirier, Matthew JE Maksoud, Yun-Yan Xiang, Rudolf AW Veldhuizen, Sean E Gill, Sean P Cregan, Haibo Zhang, Gregory A Dekaban, Wei-Yang Lu
Journal: Cellular Immunology (2018)
Three-dimensional model of intracellular and intercellular Ca2+ waves propagation in endothelial cells
Authors: Toshihiro Sera, Shingo Komine, Masataka Arai, Yasuhiro Sunaga, Hideo Yokota, Susumu Kudo
Journal: Biochemical and Biophysical Research Communications (2018)
Effect of stem cell niche elasticity/ECM protein on the self-beating cardiomyocyte differentiation of inducedpluripotent stem (iPS) cells at different stages
Authors: Mitsuhi Hirata, Tetsuji Yamaoka
Journal: Acta Biomaterialia (2017)
Emerin plays a crucial role in nuclear invagination and in the nuclear calcium transient
Authors: Masaya Shimojima, Shinsuke Yuasa, Chikaaki Motoda, Gakuto Yozu, Toshihiro Nagai, Shogo Ito, Mark Lachmann, Shin Kashimura, Makoto Takei, Dai Kusumoto
Journal: Scientific Reports (2017)
Preliminary findings on ultrasound modulation of the electromechanical function of human stem-cell-derived cardiomyocytes
Authors: Andrew William Chen, Aleksandra Klimas, Vesna Zderic, Ivan Suares Castellanos, Emilia Entcheva
Journal: (2017): 1–4
The role of spatial organization of Ca (2+) release sites in the generation of arrhythmogenic diastolic Ca (2+) release in myocytes from failing hearts.
Authors: Andriy E Belevych, Hsiang-Ting Ho, Ingrid M Bonilla, Radmila Terentyeva, Karsten E Schober, Dmitry Terentyev, Cynthia A Carnes, Sándor Györke
Journal: Basic research in cardiology (2017): 44
Dynamic polyrotaxane-coated surface for effective differentiation of mouse induced pluripotent stem cells into cardiomyocytes
Authors: Ji-Hun Seo, Mitsuhi Hirata, Sachiro Kakinoki, Tetsuji Yamaoka, Nobuhiko Yui
Journal: RSC Advances (2016): 35668–35676
Individual evaluation of cardiac marker expression and self-beating during cardiac differentiation of P19CL6 cells on different culture substrates
Authors: Tetsuji Yamaoka, Mitsuhi Hirata, Takaaki Dan, Atsushi Yamashita, Akihisa Otaka, Takahiko Nakaoki, Azizi Miskon, Sachiro Kakinoki, Atsushi Mahara
Journal: Journal of Biomedical Materials Research Part A (2016)